Als Bodenreaktion wird die Säure- oder Basenwirkung der Bodenlösung bezeichnet. Sie beruht auf der Konzentration der Wasserstoff(H+)-Ionen in der Bodenlösung und wird als pH-Wert gemessen.
Definitionsgemäß gibt der pH-Wert den negativ dekadischen Logarithmus der H + -Ionenkonzentration in Gramm pro Liter Lösung an:
pH x= 10-xg
H+/ l |
Bei einem pH-Wert von 7 befinden sich dementsprechend 10-7 (= 1 : 10.000.000)g H+-Ionen in einem Liter Messflüssigkeit bzw. Bodenlösung. Da die Menge an OH--Ionen in diesem Fall gleich groß ist, bezeichnet man bei einem pH-Wert von 7 die Bodenreaktion als neutral. Steigt die H+-Ionenkonzentration, dann fällt aufgrund seiner Maßeinheit (s.o.) der pH-Wert und die Bodenlösung reagiert zunehmend sauer. Eine saure Bodenreaktion (pH < 7) wird als Bodenacidität bezeichnet. Sinkt dagegen die H + -Ionenkonzentration, nimmt die OH - -Ionenkonzentration zu und der pH-Wert steigt. Die Bodenlösung reagiert analog dazu zunehmend basisch bzw. alkalisch und die Bodenreaktion wird entsprechend als Bodenalkalität bzw. Bodenbasizität (pH > 7) charakterisiert. Die pH-Wert-Skala reicht von 0 bis 14 (s. Abb.).
Die pH-Wert-Messung erfolgt aufgrund
einer besseren Reproduzierbarkeit häufig in verdünnten
Elektrolytsuspensionen. In der Regel wird dazu die Bodenprobe
mit einer 0,01 n Calciumchlorid (CaCl2) -Lösung
aufgeschlämmt.
Da hierbei die an den Austauschern (s. Ionenaustausch)
sorbierten H+-Ionen von den CaCl 2 -Ionen verdrängt
werden, liegt der so gemessene pH-Wert etwa 0,3-1,0 Einheiten
unter dem pH-Wert, der in wässrigen Suspensionen gemessen
wird. Die Bodenreaktion ist also saurer. Gemessen wird
hier die aktive bzw. aktuelle
Acidität , welche der
freien H+-Ionenkonzentration in der Bodenlösung
entspricht. Zur Charakterisierung eines Standortes ist
aber auch die potentielle Acidität von
Interesse. Sie bezieht die Konzentration der H+-
und Aluminuim (Al3+)-Ionen im Kationenbelag
der Austauscher mit ein, die durch Kationenaustausch (s.
Ionenaustausch)
in die Bodenlösung gelangen können
und dort die H+-Ionenkonzentration deutlich erhöhen
können. Insbesondere Al3+-Ionen sorgen für
einen Aciditätsschub, weil sie mit den Wassermolekülen
in der Bodenlösung reagieren und dabei jeweils 3 H+-Ionen
freisetzen (Al3+ + H2O ![]() Al(OH)3 +
3 H+).
Al(OH)3 +
3 H+).
In den mitteleuropäischen Böden
schwankt der aktuelle pH-Wert zwischen 3 und 8 (s. Abb.),
wobei die meisten Böden
schwach sauer reagieren (pH 5,0-6,5). Diese mehr oder weniger
starke Bodenacidität resultiert aus verschiedenen H+-Ionen
produzierenden Prozessen. In diesem Zusammenhang spielen
die Atmungsprozesse der Bodentiere, Mikroorganismen und Pflanzenwurzeln
eine gewichtige Rolle, weil das dabei exhalierte Kohlenstoffdioxid
(CO2) mit den Wassermolekülen
in der Bodenlösung reagiert (s. Bodenatmung).
Dabei entsteht Kohlensäure (H2CO3),
die dissozieren kann und dabei H+-Ionen freisetzt:
CO2 + H2O ![]() H2CO3
H2CO3
![]() H+ + HCO3- .
H+ + HCO3- .
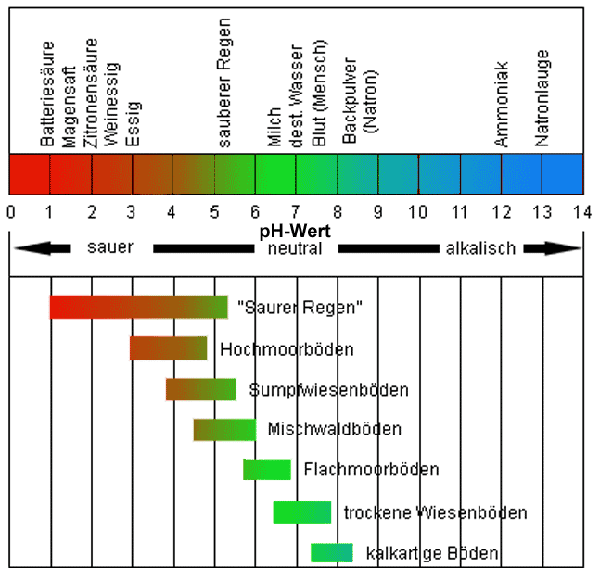 |
Bodenreaktion und pH-Werte
verschiedener mitteleuropäischer Böden |
Weiterhin spielt die Humifizierung der organischen Substanz eine wichtige Rolle. Die dabei entstehenden Fulvo- und Huminsäuren können den pH-Wert noch stärker erniedrigen als Kohlensäure. Darüber hinaus tragen verschiedene Oxidations- und Säurebildungsprozesse im Boden sowie der Einsatz sauer wirkender Düngemittel (z.B. Ammoniumsulfat) zur Erhöhung der Acidität bei.
Grundsätzlich ist die Produktion von H+ -Ionen mit der Verdrängung austauschbarer Kationen wie Ca2+, Mg2+, K+ und Na+ von den Austauschern verbunden (s. Ionenaustausch). Eine stärkere pH-Wert-Absenkung tritt aber erst ein, wenn diese desorbierten Kationen der Bodenlösung z.B. durch Auswaschung oder Ionenaustausch mit der Pflanzenwurzel entzogen werden.
Allgemein lässt sich im humiden Klimabereich (Niederschlagsrate > Verdunstungsrate) im Bodenprofil mit zunehmender Bodentiefe ein deutlicher pH-Wert-Anstieg nachweisen. Das liegt daran, dass die H+-Ionen- Produktion (z.B. durch Atmunsprozesse) und der Verlust basischer Kationen (z.B. durch Nährstoffentzug oder Auswaschung) im humosen, stark belebten und durchwurzelten Oberboden bei abwärts gerichteter Wasserbewegung höher sind als im Unterboden. Je basenreicher das mineralische Ausgangsgestein, desto deutlicher ist dieser pH-Wert-Unterschied zwischen den einzelnen Bodenhorizonten. Je höher die Basensättigung an den Austauschern, desto höher ist auch die Pufferungskapazität des Bodens, d.h. seine Fähigkeit, durch Ionenaustausch die H+-Ionen-Konzentration in der Bodenlösung zu "neutralisieren" bzw. den pH-Wert konstant zu halten. Von zentraler Bedeutung ist in diesem Zusammenhang der Kalkgehalt des Ausgangsgesteins.
Insgesamt gesehen wirkt sich die Bodenreaktion auf zahlreiche pedogenetische Prozesse der Bodenentstehung und -entwicklung aus. So beschleunigt eine hohe Bodenacidität z.B. die chemische Verwitterung (s. Abb.). Darüber hinaus werden aber auch ökologische Prozesse nachhaltig beeinflusst. Dazu zählen beispielsweise die biologische bzw. biotische Aktivität (s. Bodenaktivität), die aufgrund der Säure- und Basenempfindlichkeit vieler Mikroorganismen ihr Optimum im schwach sauren bis leicht alkalischen Bereich hat (s. Abb.).
 |
| Zusammenhänge zwischen pH-Wert und verschiedenen Bodenfaktoren (Balkendicke = Maß für die Intensität der Faktoren; Abb. verändert nach SCHROEDER 1992, S. 80) |
Unter Berücksichtigung verschiedener Vorgänge im Boden liegt die optimale Bodenreaktion für die meisten Böden und die auf ihnen wachsenden Pflanzengesellschaften im mäßig sauren bis neutralen Bereich, d.h. bei einem pH-Wert zwischen 5,0 und 7,5.
Weitere Informationen:
- Nährstoffhaushalt
- Ionenaustausch und Austauschkapazität
- Redox-System und Redox-Potential
- Bodenatmung
- Bodenaktivität
- Zeigerpflanzen
Literatur:
ENSSLIN,
W./ Krahn, R./ Skupin, S. (2000): B öden untersuchen.
Wiebelsheim: Quelle & Meyer.
GISI, U./
SCHENKER, R./ SCHULIN, R./ STADELMANN, F.X./ STICHER, H.
(1997): Bodenökologie
- 2. Auflage - Stuttgart; New York: Thieme.
Scheffer, F./
Schachtschabel, P. (2002): Lehrbuch der Bodenkunde - 15.
Auflage -. Heidelberg; Berlin: Spektrum Akademischer Verlag.
Schroeder, D. (1992):
Bodenkunde in Stichworten - 5. Auflage - Berlin; Stuttgart:
Borntraeger.